线粒体与肌肤修复
纸质版见荣格Happi杂志2020年4月刊。
荣格Happi微信公众号刊发地址:https://mp.weixin.qq.com/s/j41lKZQdG4Gm-JRgv_A4vQ
以下为原文:
肌肤损伤会导致皮肤完整性及防御能力受到不同程度破坏,引起体内各种组织器官遭受各种理化因素伤害,以及病原微生物入侵和多种继发感染。肌肤损伤修复的研究广泛分布于皮肤科、烧烫伤科、整形外科等医学领域,以及美容护肤等消费领域。
笔者团队在2月刊的上篇中已从肌肤衰老角度,简要梳理了线粒体的研究历史、结构功能、能量代谢与电子传递链、自由基与氧化应激等概念;本篇作为下篇,将进一步探讨线粒体与肌肤修复的策略,并重点介绍线粒体与炎
症、线粒体稳态及动力学、钙稳态、损伤修复、创面愈合、紫外损伤、皮肤屏障及敏感肌、角膜修复以及干细胞的关系。
线粒体与炎症及氧化应激
皮肤是保护人体免受外界伤害与刺激的重要保护层。受到感染、创伤、细菌和高温等外来刺激时,皮肤的免疫系统会启动,激活免疫细胞,引发炎症反应。炎症的发生、发展与线粒体功能密切相关,线粒体不仅可以调控固有免疫细胞中的炎症反应,也可以作用于炎症介质。炎症介质是由白细胞等免疫细胞或组织中非免疫细胞产生的物质,主要有7大类:血管活性胺类 (组胺、5-羟色胺);血管活性肽类如P物质、激肽、血纤维蛋白肽A等;补体成分如C3a、C4a和C5a;脂类介质如类花生酸、血小板活化因子等;细胞因子如肿瘤坏死因子-α(TNF-α)、白细胞介素1(IL-1)等;趋化因子;蛋白酶如弹性蛋白、组织蛋白酶、金属蛋白酶等。
上篇已提及,线粒体DNA(mtDNA)可通过结合并激活三条炎症通路的相应受体,即Toll样受体蛋白(TLR)、核苷酸结合寡聚化结构域样受体蛋白(NLRP)和细胞质循环GMP-AMP合成酶-干扰素基因刺激因子DNA(cGAS-STING DNA)传感系统介导的途径参与炎症反应:TLR途径由损伤相关分子模式(DAMPs)与中性粒细胞的结合触发,上调NF-κB信号传导并促进细胞核DNA表达更多的次级炎症因子,如TNF-α和IL-6等;NLRP途径通过NLRP3炎性小体起作用,NLRP3活化导致凋亡蛋白酶-1(caspases-1)表达增加,从而分裂并激活白细胞介素IL-1β和IL-18;cGAS-STING DNA途径则通过趋化STING蛋白触发干扰素调节因子(IRF)的磷酸化与TANK结合酶(TBK)发挥作用,同时可诱导产生Ⅰ型、Ⅲ型干扰素(β和λ1)。

线粒体稳态及动力学
线粒体在细胞内表现为一类高度动态的细胞器,通过不断地分裂、融合运动来保持线粒体稳态,即线粒体动力学。 线粒体融合增加了线粒体之间的相互联系,使线粒体基质蛋白和mtDNA通过网络状结构进行交换。相反,线粒体分裂可使其数量增多,并且通过自噬保证功能完整。线粒体动力学调控与细胞代谢、增殖、凋亡等各种功能密切相关,调控功能损伤会导致许多疾病,如神经降解性疾病、肥胖、糖尿病和癌症等。
线粒体稳态调节与ROS及多种炎症因子具有密切的关系。线粒体动力学失衡导致线粒体内ROS增加,可诱导动力相关蛋白1(Drp1)活化使线粒体碎片化。白介素-IL6可通过上调线粒体分裂蛋白1(Fis1)表达并下调线粒体外膜融合蛋白2(Mfn2)蛋白表达,使线粒体分裂增加。胰岛β细胞中TNF-ɑ可以激活NF-κB,使视神经萎缩蛋白(OPA1)表达增加,促进线粒体融合,同时提高线粒体氧化磷酸化水平和ATP产能,从而满足线粒体融合的能量需求。

细胞凋亡是一系列以凋亡蛋白酶(caspases)激活为基础、以不引起炎性反应为特征的病理过程。2014年,Rongvaux与White同时独立发现线粒体是决定死亡体细胞“命运”的核心因素:一方面死亡的体细胞释放mtDNA,经cGAS-STING通路生成一系列炎性因子,诱导死亡体细胞向坏死发展;另一方面线粒体内caspases可自发激活,caspase 9经caspase 3和caspase 7抑制DAMPs(尤其是mtDNA)引起的炎性反应,诱导死亡体细胞向凋亡发展。线粒体这种“双向”功效在维持宿主免疫平衡中具有重要的调节作用。线粒体自噬与炎症息息相关,在致炎因子刺激下,线粒体自噬水平升高,可清除损伤线粒体,并促进健康线粒体增殖来改善线粒体稳态和功能,发挥抗炎效应。此外,细胞自噬以“自噬体”形成为特征,是宿主借助线粒体赖以清除损伤细胞器、蛋白降解物及废弃细胞的重要手段。

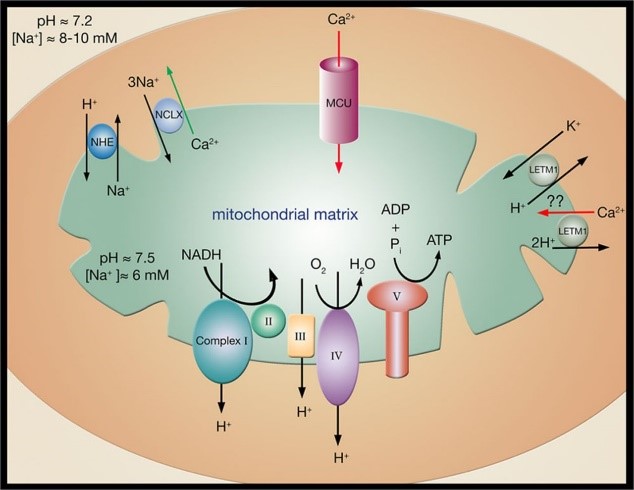
线粒体与钙稳态
Ca2+是调节细胞生理活动的重要元素。线粒体是细胞内重要的Ca2+池,也是第一个被发现参与Ca2+转运的细胞器。线粒体通过线粒体钙离子单向转运蛋白(MCU)、雷诺丁受体(RyR)等摄取Ca2+,通过钠钙交换体(NCX)、线粒体渗透性转换孔(mPTP)等释放Ca2+,调节自身与胞内Ca2+浓度,维持Ca2+稳态。ROS可引起线粒体内外Ca2+稳态失衡,使细胞外Ca2+大量内流,产生“钙超载”,导致线粒体、细胞、组织功能障碍。过量Ca2+还可以激活诱导性一氧化氮合酶(iNOS),ROS和NO生成增多,进一步加重氧化应激和氮化应激,造成线粒体氧化磷酸化障碍,ATP合成减少,产生更多ROS,形成恶性循环。健康线粒体在细胞应激状态下,通过对Ca2+摄取和释放调节细胞凋亡与自噬,在Ca2+缓冲过程中起重要作用。
线粒体与损伤修复
线粒体的结构及功能改变在问题肌肤与损伤修复的过程中处于核心地位,并全面参与损伤修复的炎症期→增殖期→塑形期三个阶段:

线粒体在炎症期
如前所述,线粒体在损伤炎症的发生和发展过程中发挥核心作用。损伤修复的早期伴随不同程度的组织坏死和血管断裂出血,随后出现炎症反应。炎症过程中线粒体既是ROS的重要来源,又是其损伤靶点,形成恶性循环,加剧炎症反应。当肌肤过度损伤时,线粒体在正常情况下数目、结构、动力学和功能的动态平衡被破坏,进而产生过量ROS,以及炎症激活体,减慢损伤修复。而线粒体自噬、分裂融合等动力学过程可清除损伤的线粒体,
促进健康线粒体生成,进而改善线粒体稳态和功能,发挥抗炎效应。此外,mtDNA被发现是一种内源性致炎因子,在机体损伤后释放入血,引起炎症反应。
线粒体在增殖期
增殖期始于损伤创面形成后2~24天,涉及上皮再生和肉芽组织生成,后者是肌肤修复的关键。线粒体一方面提供细胞生长所需ATP能量基础,一方面提供氧气与营养等物质基础,促进毛细血管新生。研究发现,毛细血管新生量与肉芽组织生成速度正相关,与创面修复时间负相关,而线粒体能有效改善损伤部位缺血缺氧微环境,加速肉芽生成,清除坏死组织。同时,线粒体内储存的Ca2+能上调一氧化氮合酶(NOS)活性,通过调控NO代谢平衡诱发血管新生,加速基质重塑,并诱导成纤维细胞、内皮细胞等增殖。此外,线粒体参与调控血管内皮细胞生长因子(VEGF)、碱性成纤维细胞生长因子(bFGF)和血小板衍生生长因子(PDGF)等生长因子(GF)释放,进而促进血管内皮分裂与血管再生,促进肉芽生成与损伤修复。
线粒体在塑形期
塑形期长可一年以上,涉及皮肤干细胞、成纤维细胞、胶原纤维等,表现为上皮细胞持续分裂,促进表皮层增厚,以及胶原纤维重排、血管重分布,促进肉芽组织内部转型。此阶段多能干细胞(PSCs,详见干细胞部分)由静止期迅速大量增殖并向创面迁移,不对称分裂增殖为大量短暂扩增细胞,进一步分化为成纤维细胞和血管内皮细胞,促进损伤修复。
分布于真皮层的成纤维细胞在损伤修复后期发挥重要作用,负责合成分泌胶原蛋白、弹性纤维蛋白和基质成分,促进细胞和组织损伤修复所必需的细胞增生、基质形成与肉芽生成,并通过分泌基质金属蛋白酶(MMPs)及金属蛋白酶组织抑制剂(TIMPs)等胶原酶参与修复后组织改建和疤痕修复。成人皮肤以Ⅰ型胶原为主,其含量取决于合成代谢的动态平衡,成纤维细胞新合成的胶原分泌至细胞外后,端肽被特异性蛋白酶水解形成Ⅰ型前胶原羧基末端肽,而分解胶原最关键的酶MMP-1、MMP-2及作用与其相反的TIMPs深度参与维持胶原正常含量的过程。
在此过程中,线粒体膜电位反映皮肤成纤维细胞状态:健康正常的线粒体可以保持稳定的膜电位,促进成纤维细胞转换和分泌,加速皮肤修复;而功能障碍的线粒体膜电位发生去极化,导致成纤维细胞功能过度活跃、ATP水平显著升高及过度增殖,产生过量胶原蛋白与纤维蛋白,进而引起瘢痕异常增生,影响肌肤修复。
线粒体与难愈创面
难愈创面指治疗1月以上未能愈合、也无愈合倾向的创面。主要包括创伤性、压迫性、放射性、下肢静脉性、糖尿病压力性溃疡、糖尿病足、严重创伤合并感染等。前文已提及,肌肤损伤修复主要以成纤维细胞增殖、迁移、肉芽形成、胶原分泌、胶原化瘢痕形成及组织重建为特点。肌肤创面细菌感染后会激活免疫细胞,释放炎性因子、蛋白水解酶和ROS,导致表皮及肉芽组织无法形成、坏死组织残留及微循环障碍;在这个过程中,各种细胞基质、炎性介质及GF相互作用,使创面无法正常修复。目前其分子学机制研究主要集中于创面GF水平、MMPs和TiMPs等。
线粒体自噬与糖尿病足
线粒体自噬对保护细胞膜、保持线粒体正常膜电位起着重要作用,可减轻细胞永久性损伤。线粒体自噬可清除受损线粒体,降低细胞内ROS积累、mtDNA受损及细胞癌化率,避免细胞凋亡、坏死。研究表明,线粒体自噬调控的机制会被缺血缺氧等刺激过度激活,引起线粒体的过度清除。而糖尿病足(DFU)多伴随局部缺血缺氧、营养匮乏及细胞凋亡;此条件下线粒体会启动自噬调控,消除衰老和变异细胞,促进细胞新生。其中线粒体膜通透性转换(MPT)的程度往往影响线粒体自噬调控机制是否启动和细胞是否凋亡,因此把控线粒体自噬分子通路可保护细胞,促进损伤修复与愈合。
线粒体与紫外线损伤
随着臭氧层破坏和紫外线(UV)辐射量增加,皮肤光老化出现泛发趋势,UV引起的炎症性皮肤病(如慢性光化性皮炎、多形性日光疹等)与皮肤肿瘤(如鳞状细胞癌、基底细胞癌等)发病率也逐年上升。UV照射引起皮肤光老化及损伤的机制包括氧化应激、DNA损伤、细胞凋亡、MMPs作用、炎症反应及免疫抑制、晚期糖基化终末产物(AGEs)作用等,其作用过程均与线粒体功能直接相关。

UV辐射可直接或间接损伤DNA。UVB引起KC的DNA损伤包括DNA链断裂与结构破坏、碱基(对)切除/替换等,诱发DNA同条链内相邻的嘧啶碱基产生环丁烷嘧啶二聚体和嘧啶-嘧啶酮光产物,激活原癌基因且使抑癌基因失活,诱导皮肤肿瘤发生等;长波紫外线(UVA)则可通过诱导ROS大量生成产生继发性氧化损伤,如诱发DNA形成环丁烷嘧啶二聚体特别是胸腺嘧啶二聚体、氧化鸟嘌呤形成8-羟基脱氧鸟苷、断裂单链DNA、使DNA蛋白交联、改变DNA空间结构、阻碍DNA复制与转录等,进而影响蛋白质功能并加强UVB致癌作用。
线粒体与皮肤屏障、敏感肌及红血丝
皮肤屏障,广义包括物理屏障、色素屏障、神经屏障、免疫屏障;狭义仅指物理屏障。皮肤屏障受损可引起皮肤干燥、老化、激素脸、红血丝、湿疹、日光性皮炎等敏感肌肤问题以及银屑病、鱼鳞病、刺激性皮炎、激素依赖性皮炎等皮肤疾病。按其类型及形成机理可分为原发性与继发性,其中继发性常见高原性气候、物理因素刺激如紫外线与高温低温、化学因素刺激、疾病并发症如瘢痕与放射性皮炎等。
修复皮肤屏障需逐步修复角质层与血管内皮,提高皮肤耐受力和抵抗力。如前所述,线粒体深度参与表皮及血管内皮细胞的功能调控。仅以线粒体调控与皮肤屏障密切相关的Ca2+为例:正常皮肤中存在自基底层到颗粒层再到角质层由低到高的Ca2+浓度梯度,对于表皮增生、分化、细胞间连接及屏障功能意义重大。作为细胞中重要的Ca2+池,线粒体可参与控制Ca2+浓度、皮肤细胞分裂分化、皮脂合成分泌、皮肤屏障功能再生以及预防医美术后返黑等过程。
线粒体与角膜修复
角膜疾病与线粒体功能障碍高度相关。角膜结构从外到内依次包括:上皮层、Bowman层、基质层、Descemet膜、内皮层,主要有3种细胞:上皮细胞、基质中的角质细胞和高度分化的内皮细胞。角膜高度暴露于自然界,先天或后天长时间暴露于外界紫外线和高氧环境,加之其生理结构使其本身易受ROS和氧化损伤影响。角膜氧化和抗氧化剂水平失衡会导致mtDNA突变,且随时间推移不断累积,超过阈值后细胞产生能量障碍,表现为各种角膜损伤疾病。随着对线粒体异常在角膜损伤的研究逐渐加深,未来靶向线粒体治疗角膜损伤疾病,并预防或减少视力丧失的功能成分将不断涌现。
线粒体与干细胞
多能干细胞(PSCs)主要包括胚胎干细胞(ESCs)和诱导性多能干细胞(iPSCs),线粒体融合分裂的动态平衡在调控PSCs的多能性及生存方面发挥独有作用,即在多能性状态下,PSCs主要依靠糖酵解提供能量,产能效率低;在其分化期间主要通过氧化磷酸化为基础的有氧代谢提供能量,且代谢能力逐渐增强。另外,线粒体可通过生物合成和形态结构的动态重塑维持PSCs多能性、合成代谢、氧化还原平衡、诱导分化及iPSCs重编程。
厌氧刺激糖酵解或抑制线粒体呼吸可促进PSCs维持多能性。尽管糖酵解产能效率低,但可有效降低线粒体呼吸及ROS产量,增强葡萄糖经由磷酸戊糖的代谢途径,产生还原因子NADPH激活抗氧化酶,这在低氧条件下对维持干细胞多能性,促进干细胞增殖,调控氧化还原状态具有重要作用。基于此,Lonergan等提出将线粒体形态、定位、数量及功能作为评价PSCs是否具备多能性的标志。

结语
线粒体是快速动态变化的细胞器,在细胞内形成一个动态的可塑性网络。作为细胞代谢和信号传导网络的中心,线粒体是维持细胞正常生理功能最重要的细胞器之一,其功能完整性与肌肤健康完整密切相关。遗憾的是,在医学及护肤领域,目前鲜有以线粒体为靶点进行肌肤修复及肌肤抗衰的相关研究,更缺乏兼顾肌肤修复与抗衰需求的全能功效成分。笔者团队抛砖引玉,分上下两篇简要探讨了线粒体与肌肤衰老及肌肤修复的关系。随着Corrective Skincare(矫正性护肤)以及Preventative/Protective Skincare(预防性护肤/保护性护肤)等精准护肤理念逐渐被95后年轻群体重视与追捧,相信线粒体作为科技感与概念感兼备的黄金靶点,将成为专业及日用护肤领域的新风口,掀起新一轮研究与消费热潮。
参考文献:
[1] Newmeyer DD. et al. Mitochondria: releasing power for life and unleashing the machineries of death. Cell 2003: 112: 481.
[2] Balaban RS. et al. Mitochondria, oxidants, and aging. Cell 2005, 120: 483.
[3] Ott M. et al. Mitochondria, oxidative stress and cell death. Apoptosis 2007, 12: 913.
[4] Murphy MP. How mitochondria produce reactive oxygen species. Biochem. J. 2009, 417(1) : 1.
[5] Panel M. et al. Mitochondria and aging: a role for the mitochondrial transition pore? Aging Cell 2018, Article e12793.
[6] Singh B. et al. Reversing wrinkled skin and hair loss in mice by restoring mitochondrial function. Cell Death Dis. 2018, 9:735.
[7] Stout R. et al. Mitochondria’s role in skin ageing. Biology 2019, 8: 29.

